Obsolescenza e inadeguatezza dei materiali per i Dispositivi Medici
di Anthea Palo
Il Regolamento (UE) 2017/745 ha messo in rilievo la necessità di aumentare gli standard di sicurezza ed efficacia dei dispositivi medici al fine di garantire un prodotto che rispetti la performance prevista dal fabbricante e soprattutto la sicurezza degli utilizzatori. Purtroppo sono proprio i numerosi incidenti che si sono verificati nel corso degli anni che hanno spinto verso dei requisiti di sicurezza più stringenti.
I risultati dell’indagine realizzata dall’Osservatorio parco installato (Opi) di Confindustria dispositivi medici evidenzia lo stato di obsolescenza del parco tecnologie di diagnostica per immagini in uso presso le strutture sanitarie italiane pubbliche e private, nell’anno 2019. Sono 18.000 le apparecchiature di diagnostica per immagini obsolete come risonanze magnetiche, Pet, Tac, angiografi e mammografi. Il 71% dei mammografi convenzionali ha superato i 10 anni di età, il 69% delle PET ha più di 5 anni e il 54% delle risonanze magnetiche chiuse 1,0 T hanno ancora oltre 10 anni (a fronte di un periodo di adeguatezza di 5 anni). (fonte: Confindustria dispositivi medici)
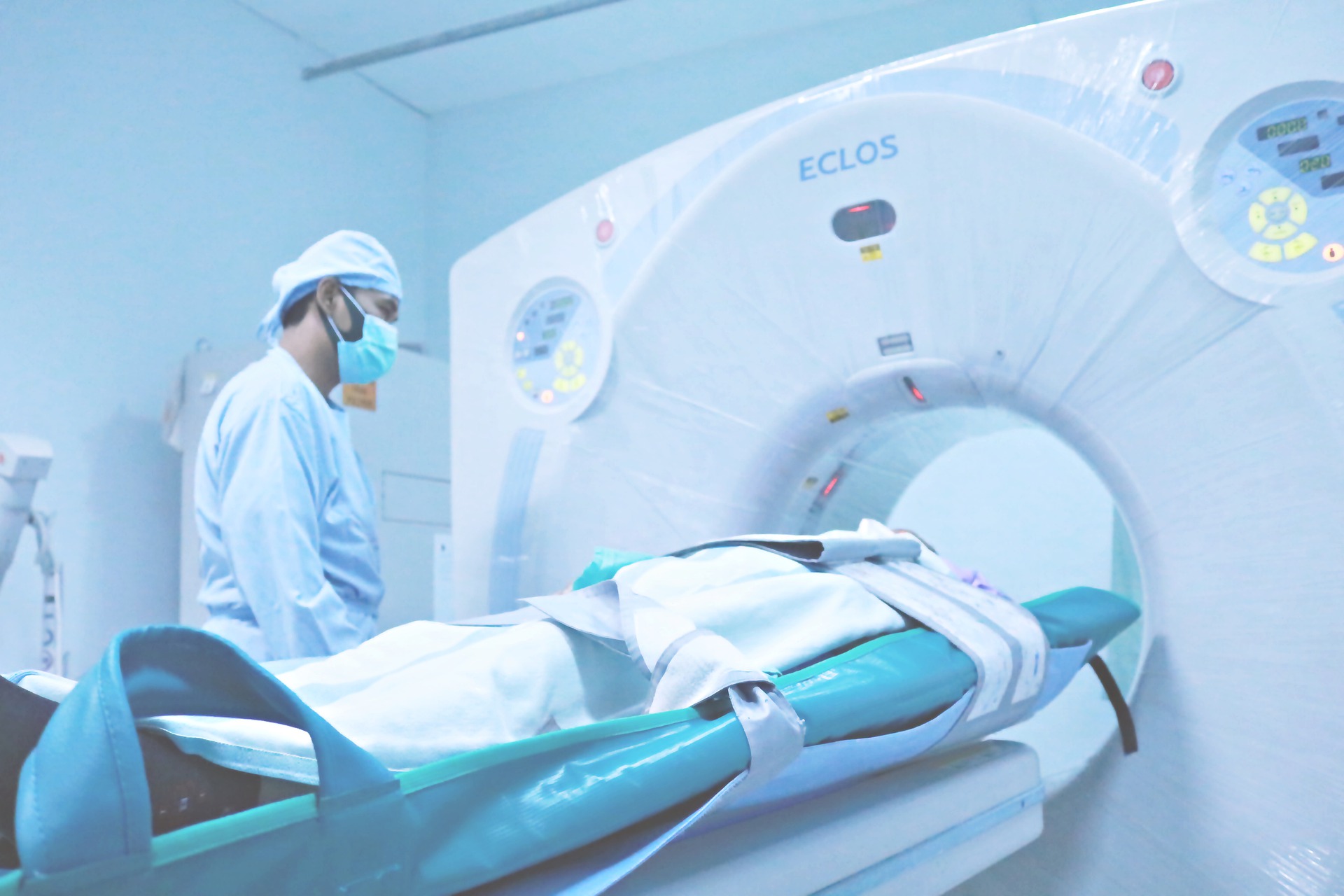 Rischio maggiore correlato alla desuetudine di tali apparecchiature è il ritardo nella diagnosi, conseguente ad un mancato rilevamento di potenziali lesioni maligne e ancora per gli operatori che impiegano strumenti diagnostici, un’esposizione ad una quantità di radiazioni ad oggi non accettabili. Non solo l’obsolescenza presente in Italia, ma facendo riferimento ad altri paesi Europei si evince come anche l’inadeguatezza dei materiali possa rappresentare un pericolo per la salute degli utilizzatori dei dispostivi. Infatti, uno degli incidenti maggiormente discussi nel panorama dei DM riguarda un fabbricante francese di protesi mammarie (Poly Implant Prothèse). Da un’ispezione svolta dalle Autorità Francesi si è scoperto che per anni il fabbricante ha utilizzato silicone industriale anziché silicone di grado medico per la produzione di protesi mammarie, danneggiando in queto modo la salute di migliaia di donne nel mondo. Problemi simili sono stati rilevati anche per le protesi d’anca in cromo-cobalto DePuy, le cui componenti metalliche rilasciavano microparticelle nel sangue in pericolose quantità.
Rischio maggiore correlato alla desuetudine di tali apparecchiature è il ritardo nella diagnosi, conseguente ad un mancato rilevamento di potenziali lesioni maligne e ancora per gli operatori che impiegano strumenti diagnostici, un’esposizione ad una quantità di radiazioni ad oggi non accettabili. Non solo l’obsolescenza presente in Italia, ma facendo riferimento ad altri paesi Europei si evince come anche l’inadeguatezza dei materiali possa rappresentare un pericolo per la salute degli utilizzatori dei dispostivi. Infatti, uno degli incidenti maggiormente discussi nel panorama dei DM riguarda un fabbricante francese di protesi mammarie (Poly Implant Prothèse). Da un’ispezione svolta dalle Autorità Francesi si è scoperto che per anni il fabbricante ha utilizzato silicone industriale anziché silicone di grado medico per la produzione di protesi mammarie, danneggiando in queto modo la salute di migliaia di donne nel mondo. Problemi simili sono stati rilevati anche per le protesi d’anca in cromo-cobalto DePuy, le cui componenti metalliche rilasciavano microparticelle nel sangue in pericolose quantità.
Alla luce di questi e tanti altri scandali, per garantire un livello elevato di sicurezza e prestazione, è opportuno che la dimostrazione della conformità ai requisiti generali di sicurezza e prestazione stabiliti dal MDR si basi su più dati clinici (da indagini cliniche, studi sul DM equivalente, dalla letteratura scientifica) rispetto alla vecchia direttiva. Un’ulteriore fonte di dati clinici sono le attività di sorveglianza post commercializzazione (PMS) e del follow-up clinico post commercializzazione (PMCF), ossia attività proattive di raccolta dati che il Fabbricante deve svolgere durante l’intera vita del DM in modo da monitorare la sua sicurezza e la performance anche dopo la certificazione e immissione in commercio.
Biochem Consulting, grazie al suo team di esperti, può supportare i Fabbricanti di Dispositivi Medici nell’aggiornamento della documentazione tecnica in accordo ai Regolamenti 2017/745 e 2017/746; nella preparazione dei piani PMS e PMCF; nella vigilanza e sorveglianza post Market dei DM.
Tel. 081.1890.2885

